Cyklin-dependentní kináza 2 - Cyclin-dependent kinase 2
Cyklin-dependentní kináza 2, také známý jako buněčné dělení protein kinázy 2, nebo Cdk2, je enzym že u lidí je kódován CDK2 gen.[5][6] The protein kódovaný tímto genem je členem cyklin-dependentní kináza rodina Ser / Thr proteinové kinázy. Tato proteinová kináza je velmi podobná genovým produktům S. cerevisiae cdc28, a S. pombe cdc2, také známý jako Cdk1 u lidí. Je to katalytická podjednotka cyklin-dependentní kináza komplex, jehož aktivita je omezena na fázi G1-S v buněčný cyklus kde buňky vytvářejí proteiny nezbytné pro mitózu a replikují svou DNA. Tento protein se asociuje a je regulován regulačními podjednotkami komplexu včetně cyklin E nebo A. Cyklin E váže fázi G1 Cdk2, která je nutná pro přechod z fáze G1 do fáze S, zatímco vazba s cyklinem A je nutná pro postup fází S.[7] Jeho činnost je rovněž regulována fosforylace. Bylo popsáno několik alternativně sestřižených variant a více iniciačních míst transkripce tohoto genu.[8] Úloha tohoto proteinu v přechodu G1-S byla nedávno zpochybněna, protože se uvádí, že buňky postrádající Cdk2 nemají během tohoto přechodu žádný problém.[9]
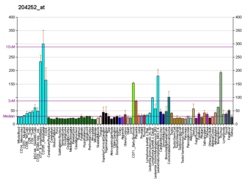
Výdej v normálně fungující tkáni
Původní experimenty založené na buněčné kultuře prokázaly zastavení buněčného cyklu při přechodu G1-S vyplývajícím z delece Cdk2.[10] Pozdější experimenty ukázaly, že delece Cdk2 prodloužily G1 fáze buněčného cyklu ve fibroblastech myších embryí. Stále však vstoupili S fáze po tomto období a byli schopni dokončit zbývající fáze buněčného cyklu.[11] Když byl Cdk2 odstraněn u myší, zvířata zůstala životaschopná i přes zmenšení velikosti těla. Meiotická funkce samců i samic myší však byla inhibována. To naznačuje, že Cdk2 není nezbytný pro buněčný cyklus zdravých buněk, ale nezbytný pro redukční dělení buněk a reprodukce.[10] Buňky v Cdk2 knockoutovaných myších pravděpodobně podstoupily méně dělení, což přispělo ke zmenšení velikosti těla. Zárodečné buňky se také přestávají dělit v profázi meiózy, což vede k reprodukční sterilitě.[11] Nyní se předpokládá, že Cdk1 kompenzuje mnoho aspektů delece Cdk2, kromě meiotické funkce.[10]
Mechanismus aktivace
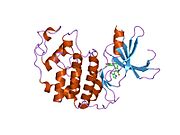
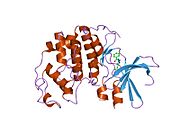
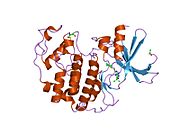
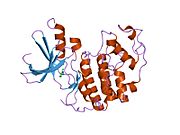
Cyklin-dependentní kináza 2 je strukturována ve dvou lalocích. Lalok začínající na N-konci (N-lalok) obsahuje mnoho beta listů, zatímco lalok na C-konci (C-lalok) je bohatý na alfa šroubovice.[7] Cdk2 je schopen vázat se na mnoho různých cyklinů, včetně cyklinů A, B, E a případně C.[10] Nedávné studie naznačují, že Cdk2 se přednostně váže na cykliny A a E, zatímco Cdk1 dává přednost cyklinům A a B.[12]
Cdk2 se stává aktivním, když se cyklinový protein (buď A nebo E) váže na aktivní místo umístěné mezi laloky N a C kinázy. Vzhledem k umístění aktivního místa interagují partnerské cykliny s oběma laloky Cdk2. Cdk2 obsahuje důležitou alfa šroubovici umístěnou v C laloku kinázy, nazývanou C-spirála nebo PSTAIRE-spirála. Hydrofobní interakce způsobují asociaci C-šroubovice s jinou šroubovicí v aktivujícím cyklinu. Aktivace vyvolává konformační změnu, kde se šroubovice otáčí a pohybuje se blíže k N-laloku.[Citace je zapotřebí ] To umožňuje, aby kyselina glutamová umístěná na C-šroubovici vytvořila iontový pár s blízkým postranním řetězcem lysinu. Význam tohoto pohybu spočívá v tom, že do postranního řetězce přivádí postranní řetězec Glu 51, který patří do triády zbytků katalytického místa konzervovaných ve všech eukaryotických kinázách. Thistriad (Lys 33, Glu 51 a Asp 145) se podílí na orientaci ATP fosfátů a koordinaci hořčíku a je považován za kritický pro katalýzu. Tato konformační změna také přemístí aktivační smyčka do C-laloku, odhalující vazebné místo ATP, které je nyní k dispozici pro nové interakce. Nakonec je zbytek threoninu-160 vystaven a fosforylován, když je aktivační segment C-laloku vytlačen z katalytického místa a threoninový zbytek již není stericky bráněn. Fosforylovaný threoninový zbytek vytváří stabilitu v konečné konformaci enzymu. Je důležité si uvědomit, že během tohoto aktivačního procesu cykliny vázající se na Cdk2 nepodstoupí žádnou konformační změnu.[14][7]

Role v replikaci DNA
Úspěch procesu dělení buněk závisí na přesné regulaci procesů na buněčné i tkáňové úrovni. Komplexní interakce mezi proteiny a DNA v buňce umožňují předávání genomové DNA do dceřiných buněk. Interakce mezi buňkami a proteiny extracelulární matrice umožňují začlenění nových buněk do existujících tkání. Na buněčné úrovni je proces řízen různými úrovněmi cyklin-dependentní kinázy (Cdks) a jejich partnerské cykliny. Buňky využívají různé kontrolní body jako prostředek pro zpoždění postupu buněčného cyklu, dokud neopraví vady.[16]
Cdk2 je aktivní během G1 a S fáze buněčného cyklu, a proto působí jako G1-S kontrola kontrolního bodu fáze. Před G1 fáze se hladiny Cdk4 a Cdk6 zvyšují spolu s cyklinem D. To umožňuje částečnou fosforylaci Rb a částečnou aktivaci E2F na začátku G1 fáze, která podporuje syntézu cyklinu E a zvyšuje aktivitu Cdk2. Na konci G1 fázi dosahuje komplex Cdk2 / Cyclin E maximální aktivity a hraje významnou roli při zahájení S fáze.[17] Během G se také aktivují další proteiny jiné než Cdk1-S fázový přechod. Například retinoblastom (Rb) a proteiny p27 jsou fosforylovány komplexy Cdk2 - cyklin A / E a plně je deaktivují.[18] To umožňuje transkripčním faktorům E2F exprimovat geny, které podporují vstup do S fáze, kde se DNA před rozdělením replikuje.[19][20][18] NPAT, známý substrát komplexu Cdk2-cyklin E, navíc aktivuje transkripci genu histonu, když je fosforylován.[21] To zvyšuje syntézu histonových proteinů (hlavní proteinové složky chromatinu) a následně podporuje fázi replikace DNA buněčného cyklu. Nakonec na konci S fáze ubikvitinový proteazom degraduje cyklin E.[11]
Proliferace rakovinných buněk
Přestože je Cdk2 většinou postradatelný v buněčném cyklu normálně fungujících buněk, je zásadní pro abnormální procesy růstu rakovinných buněk. Gen CCNE1 produkuje cyklin E, jeden ze dvou hlavních partnerů vázajících proteiny Cdk2. Nadměrná exprese CCNE1 se vyskytuje v mnoha nádorových buňkách, což způsobuje závislost buněk na Cdk2 a cyklinu E.[12] Abnormální aktivita cyklinu E je také pozorována u rakoviny prsu, plic, kolorektálního karcinomu, žaludku a kostí, stejně jako u leukémie a lymfomu.[17] Podobně je abnormální exprese cyklinu A2 spojena s nestabilitou chromozomů a množením nádorů, zatímco inhibice vede ke snížení růstu nádoru.[22] Proto CDK2 a jeho cyklinové vazební partneři představují možné terapeutické cíle pro nová terapeutika proti rakovině.[12] Předklinické modely ukázaly předběžný úspěch v omezení růstu nádoru a bylo také pozorováno, že snižují vedlejší účinky současných chemoterapeutických léků.[23][24][25]
Identifikace selektivních inhibitorů Cdk2 je obtížná kvůli extrémní podobnosti mezi aktivními místy Cdk2 a jinými Cdks, zejména Cdk1.[12] Cdk1 je jediná esenciální cyklin dependentní kináza v buněčném cyklu a inhibice by mohla vést k nezamýšleným vedlejším účinkům.[26] Většina kandidátů na inhibitor CDK2 cílí na vazebné místo ATP a lze ji rozdělit do dvou hlavních podtříd: typu I a typu II. Inhibitory typu I kompetitivně cílí na vazebné místo ATP v jeho aktivním stavu. Inhibitory typu II cílí na CDK2 v nenavázaném stavu, buď zabírají vazebné místo ATP, nebo hydrofobní kapsu v kináze. Předpokládá se, že inhibitory typu II jsou selektivnější.[24] Nedávno vedla dostupnost nových krystalických struktur CDK k identifikaci potenciálního alosterického vazebného místa poblíž C-šroubovice. Inhibitory tohoto alosterického místa jsou klasifikovány jako inhibitory typu III.[27] Dalším možným cílem je T-smyčka CDK2. Když se cyklin A váže na CDK2, N-terminální lalok se otáčí, aby aktivoval vazebné místo ATP a přepnul polohu aktivační smyčky, která se nazývá T-smyčka.[28]
Inhibitory
Známé inhibitory CDK jsou p21Cip1 (CDKN1A ) a p27Kip1 (CDKN1B ).[29]
Léky, které inhibují Cdk2 a zastavují buněčný cyklus, jako je GW8510 a experimentální lék proti rakovině seliciclib, může snížit citlivost epitelu na mnoho protinádorových látek aktivních na buněčný cyklus, a proto představuje strategii prevence chemoterapie vyvolaných alopecie.[30]
Methylester kyseliny rosmarinové je rostlinný inhibitor Cdk2, u kterého bylo prokázáno, že potlačuje proliferaci buněk hladkého svalstva cév a snižuje neointima tvorba v myši restenóza Modelka.[31]
Podívejte se také na galerii PDB níže, která ukazuje interakce s mnoha inhibitory (včetně Purvalanol B)
Regulace genů
v melanocytární buněčné typy je exprese genu CDK2 regulována Transkripční faktor spojený s mikroftalmií.[32][33]
Interakce
Bylo prokázáno, že kináza 2 závislá na cyklinu komunikovat s:
- BRCA1,[34][35][36]
- CDK2AP1,[37]
- CDKN1B[38][39][40][41][42]
- CDKN3,[43][44][45]
- CEBPA,[46]
- Cyklin A1,[47][48][49][50]
- Cyklin E1,[38][51][52][53][54][55]
- Endonukleáza specifická pro klapkovou strukturu 1,[56]
- ORC1L,[57]
- P21,[42][45][52][58][59]
- PPM1B,[60]
- PPP2CA,[60]
- Protein podobný retinoblastomu 1,[51][61]
- Protein podobný retinoblastomu 2,[51][62] a
- SKP2.[39][58][63]

Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000123374 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000025358 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Tsai LH, Harlow E, Meyerson M (září 1991). „Izolace lidského genu cdk2, který kóduje p33 kinázu spojenou s cyklinem A a adenovirem E1A“. Příroda. 353 (6340): 174–7. Bibcode:1991Natur.353..174T. doi:10.1038 / 353174a0. PMID 1653904. S2CID 4358953.
- ^ „Entrez Gene: CDK2 cyklin-dependentní kináza 2“.
- ^ A b C Echalier A, Endicott JA, Noble ME (březen 2010). „Poslední vývoj v biochemických a strukturálních studiích na cyklin-dependentní kináze“. Biochimica et Biophysica Acta (BBA) - bílkoviny a proteomika. 1804 (3): 511–9. doi:10.1016 / j.bbapap.2009.10.002. PMID 19822225.
- ^ „Entrez Gene: CDK2 cyklin-dependentní kináza 2“.
- ^ Berthet C, Aleem E, Coppola V, Tessarollo L, Kaldis P (říjen 2003). "Cdk2 knockout myši jsou životaschopné". Aktuální biologie. 13 (20): 1775–85. doi:10.1016 / j.cub.2003.09.024. PMID 14561402. S2CID 14320937.
- ^ A b C d Satyanarayana A, Kaldis P (srpen 2009). „Regulace buněčného cyklu savců: několik Cdks, mnoho cyklinů a různé kompenzační mechanismy“. Onkogen. 28 (33): 2925–39. doi:10.1038 / dne 2009.170. PMID 19561645.
- ^ A b C Su TT, Stumpff J (březen 2004). „Pravidla promiskuity? Nepostradatelnost cyklinu E a Cdk2“. Věda STKE. 2004 (224): pe11. doi:10.1126 / stke.2242004pe11. PMC 3242733. PMID 15026579.
- ^ A b C d Wood DJ, Korolchuk S, Tatum NJ, Wang LZ, Endicott JA, Noble ME, Martin MP (listopad 2018). „Rozdíly v konformační energetické krajině CDK1 a CDK2 naznačují mechanismus pro dosažení selektivní inhibice CDK“. Cell Chemical Biology. 26 (1): 121–130.e5. doi:10.1016 / j.chembiol.2018.10.015. PMC 6344228. PMID 30472117.
- ^ PDB: 1FIN; Jeffrey PD, Russo AA, Polyak K, Gibbs E, Hurwitz J, Massagué J, Pavletich NP (červenec 1995). "Mechanismus aktivace CDK odhalený strukturou komplexu cyklinA-CDK2". Příroda. 376 (6538): 313–20. Bibcode:1995 Natur.376..313J. doi:10.1038 / 376313a0. PMID 7630397. S2CID 4361179.
- ^ Malumbres M (2014-06-30). „Cyklin-dependentní kinázy“. Genome Biology. 15 (6): 122. doi:10,1186 / gb4184. PMC 4097832. PMID 25180339.
- ^ PDB: 1W98; Honda R, Lowe ED, Dubinina E, Skamnaki V, Cook A, Brown NR, Johnson LN (únor 2005). „Struktura cyklinu E1 / CDK2: důsledky pro aktivaci CDK2 a role nezávislé na CDK2“. Časopis EMBO. 24 (3): 452–63. doi:10.1038 / sj.emboj.7600554. PMC 548659. PMID 15660127.
- ^ Bartek J, Lukas C, Lukas J (říjen 2004). Msgstr "Kontrola poškození DNA v S fázi". Recenze přírody. Molekulární buněčná biologie. 5 (10): 792–804. doi:10.1038 / nrm1493. PMID 15459660. S2CID 33560392.
- ^ A b Caruso JA, Duong MT, Carey JP, Hunt KK, Keyomarsi K (říjen 2018). „Nízkomolekulární cyklin E u lidské rakoviny: buněčné důsledky a příležitosti pro cílené terapie“. Výzkum rakoviny. 78 (19): 5481–5491. doi:10.1158 / 0008-5472.can-18-1235. PMC 6168358. PMID 30194068.
- ^ A b Giacinti C, Giordano A (srpen 2006). "RB a vývoj buněčného cyklu". Onkogen. 25 (38): 5220–7. doi:10.1038 / sj.onc.1209615. PMID 16936740.
- ^ Cobrinik D (duben 2005). "Kapesní proteiny a kontrola buněčného cyklu". Onkogen. 24 (17): 2796–809. doi:10.1038 / sj.onc.1208619. PMID 15838516.
- ^ Molekulární podstata rakoviny. Mendelsohn, John, 1936-, Gray, Joe W. ,, Howley, Peter M. ,, Israel, Mark A. ,, Thompson, Craig (Craig B.) (čtvrté vydání). Philadelphia, PA. 2015. ISBN 9781455740666. OCLC 870870610.CS1 maint: ostatní (odkaz)
- ^ Zhao J, Kennedy BK, Lawrence BD, Barbie DA, Matera AG, Fletcher JA, Harlow E (září 2000). „NPAT spojuje cyklin E-Cdk2 s regulací transkripce histonového genu závislou na replikaci“. Geny a vývoj. 14 (18): 2283–97. doi:10,1101 / gad. 827700. PMC 316937. PMID 10995386.
- ^ Gopinathan L, Tan SL, Padmakumar VC, Coppola V, Tessarollo L, Kaldis P (červenec 2014). „Ztráta Cdk2 a cyklinu A2 zhoršuje buněčnou proliferaci a tumorigenezi“. Výzkum rakoviny. 74 (14): 3870–9. doi:10.1158 / 0008-5472.CAN-13-3440. PMC 4102624. PMID 24802190.
- ^ Xia P, Liu Y, Chen J, Coates S, Liu D, Cheng Z (říjen 2018). „Inhibice cyklin-dependentní kinázy 2 chrání proti apoptóze kardiomyocytů a kardiomyopatii vyvolané doxorubicinem“. The Journal of Biological Chemistry. 293 (51): 19672–19685. doi:10.1074 / jbc.ra118.004673. PMC 6314117. PMID 30361442.
- ^ A b Whittaker SR, Mallinger A, Workman P, Clarke PA (květen 2017). „Inhibitory cyklin-dependentních kináz jako protinádorová léčiva“. Farmakologie a terapeutika. 173: 83–105. doi:10.1016 / j.pharmthera.2017.02.008. PMC 6141011. PMID 28174091.
- ^ Cicenas J, Kalyan K, Sorokinas A, Stankunas E, Levy J, Meskinyte I, Stankevicius V, Kaupinis A, Valius M (červen 2015). „Roskovitin při rakovině a jiných onemocněních“. Annals of Translational Medicine. 3 (10): 135. doi:10.3978 / j.issn.2305-5839.2015.03.61. PMC 4486920. PMID 26207228.
- ^ Brown NR, Korolchuk S, Martin MP, Stanley WA, Moukhametzianov R, Noble ME, Endicott JA (duben 2015). „Struktury CDK1 odhalují konzervované a jedinečné vlastnosti základního buněčného cyklu CDK“. Příroda komunikace. 6: 6769. Bibcode:2015NatCo ... 6.6769B. doi:10.1038 / ncomms7769. PMC 4413027. PMID 25864384.
- ^ Rastelli G, Anighoro A, Chripkova M, Carrassa L, Broggini M (09.06.2014). „Strukturální objev prvních alosterických inhibitorů cyklin-dependentní kinázy 2“. Buněčný cyklus. 13 (14): 2296–305. doi:10,4161 / cc.29295. PMC 4111683. PMID 24911186.
- ^ Pellerano M, Tcherniuk S, Perals C, Ngoc Van TN, Garcin E, Mahuteau-Betzer F, Teulade-Fichou MP, Morris MC (srpen 2017). "Cílení konformační aktivace CDK2 kinázy". Biotechnology Journal. 12 (8): 1600531. doi:10.1002 / biot.201600531. PMID 28430399.
- ^ Levkau B, Koyama H, Raines EW, Clurman BE, Herren B, Orth K, Roberts JM, Ross R. (březen 1998). „Štěpení p21Cip1 / Waf1 a p27Kip1 zprostředkovává apoptózu v endotelových buňkách aktivací Cdk2: role kaspázové kaskády“. Molekulární buňka. 1 (4): 553–63. doi:10.1016 / S1097-2765 (00) 80055-6. PMID 9660939.
- ^ Davis ST, Benson BG, Bramson HN, Chapman DE, Dickerson SH, Dold KM, Eberwein DJ, Edelstein M, Frye SV, Gampe RT, Griffin RJ, Harris PA, Hassell AM, Holmes WD, Hunter RN, Knick VB, Lackey K , Lovejoy B, Luzzio MJ, Murray D, Parker P, Rocque WJ, Shewchuk L, Veal JM, Walker DH, Kuyper LF (leden 2001). "Prevence chemoterapií vyvolané alopecie u potkanů inhibitory CDK". Věda. 291 (5501): 134–7. Bibcode:2001Sci ... 291..134D. doi:10.1126 / science.291.5501.134. PMID 11141566.
- ^ Liu R, Heiss EH, Waltenberger B, Blažević T, Schachner D, Jiang B, Krystof V, Liu W, Schwaiger S, Peña-Rodríguez LM, Breuss JM, Stuppner H, Dirsch VM, Atanasov AG (duben 2018). „Složky středomořského koření působící proti šíření buněk hladkého svalstva cév: identifikace a charakterizace methylesteru kyseliny rosmarinové jako nového inhibitoru“. Molekulární výživa a výzkum potravin. 62 (7): e1700860. doi:10.1002 / mnfr.201700860. PMID 29405576. S2CID 4634007.
- ^ Du J, Widlund HR, Horstmann MA, Ramaswamy S, Ross K, Huber WE, Nishimura EK, Golub TR, Fisher DE (prosinec 2004). „Kritická role CDK2 pro růst melanomu spojená s jeho transkripční regulací specifickou pro melanocyty MITF“. Rakovinová buňka. 6 (6): 565–76. doi:10.1016 / j.ccr.2004.10.014. PMID 15607961.
- ^ Hoek KS, Schlegel NC, Eichhoff OM, Widmer DS, Praetorius C, Einarsson SO, Valgeirsdottir S, Bergsteinsdottir K, Schepsky A, Dummer R, Steingrimsson E (prosinec 2008). "Nové cíle MITF identifikované pomocí dvoustupňové strategie DNA microarray". Výzkum pigmentových buněk a melanomu. 21 (6): 665–76. doi:10.1111 / j.1755-148X.2008.00505.x. PMID 19067971. S2CID 24698373.
- ^ Chen Y, Farmer AA, Chen CF, Jones DC, Chen PL, Lee WH (červenec 1996). „BRCA1 je 220-kDa jaderný fosfoprotein, který je exprimován a fosforylován způsobem závislým na buněčném cyklu“. Výzkum rakoviny. 56 (14): 3168–72. PMID 8764100.
- ^ Ruffner H, Jiang W, Craig AG, Hunter T, Verma IM (červenec 1999). „BRCA1 je fosforylován na serinu 1497 in vivo na fosforylačním místě cyklin-dependentní kinázy 2“. Molekulární a buněčná biologie. 19 (7): 4843–54. doi:10.1128 / MCB.19.7.4843. PMC 84283. PMID 10373534.
- ^ Wang H, Shao N, Ding QM, Cui J, Reddy ES, Rao VN (červenec 1997). „Proteiny BRCA1 jsou transportovány do jádra v nepřítomnosti sérových a sestřihových variant BRCA1a, BRCA1b jsou tyrosin fosfoproteiny, které se asociují s E2F, cykliny a cyklin dependentními kinázami“. Onkogen. 15 (2): 143–57. doi:10.1038 / sj.onc.1201252. PMID 9244350.
- ^ Shintani S, Ohyama H, Zhang X, McBride J, Matsuo K, Tsuji T, Hu MG, Hu G, Kohno Y, Lerman M, Todd R, Wong DT (září 2000). „p12 (DOC-1) je nový protein asociovaný s cyklin-dependentní kinázou 2“. Molekulární a buněčná biologie. 20 (17): 6300–7. doi:10.1128 / MCB.20.17.6300-6307.2000. PMC 86104. PMID 10938106.
- ^ A b Connor MK, Kotchetkov R, Cariou S, Resch A, Lupetti R, Beniston RG, Melchior F, Hengst L, Slingerland JM (leden 2003). „CRM1 / Ran zprostředkovaný jaderný export p27 (Kip1) zahrnuje signál jaderného exportu a spojuje export p27 a proteolýzu“. Molekulární biologie buňky. 14 (1): 201–13. doi:10,1091 / mbc.E02-06-0319. PMC 140238. PMID 12529437.
- ^ A b Rosner M, Hengstschläger M (listopad 2004). „Tuberin váže p27 a negativně reguluje jeho interakci s SCF složkou Skp2“. The Journal of Biological Chemistry. 279 (47): 48707–15. doi:10,1074 / jbc.M405528200. PMID 15355997.
- ^ Youn CK, Cho HJ, Kim SH, Kim HB, Kim MH, Chang IY, Lee JS, Chung MH, Hahm KS, You HJ (únor 2005). "Exprese Bcl-2 potlačuje aktivitu opravy nesouladu prostřednictvím inhibice transkripční aktivity E2F". Přírodní buněčná biologie. 7 (2): 137–47. doi:10.1038 / ncb1215. PMID 15619620. S2CID 42766325.
- ^ Porter LA, Kong-Beltran M, Donoghue DJ (září 2003). „Spy1 interaguje s p27Kip1, aby umožnil postup G1 / S“. Molekulární biologie buňky. 14 (9): 3664–74. doi:10,1091 / mbc.E02-12-0820. PMC 196558. PMID 12972555.
- ^ A b Law BK, Chytil A, Dumont N, Hamilton EG, Waltner-Law ME, Aakre ME, Covington C, Moses HL (prosinec 2002). „Rapamycin potencuje zastavení růstu indukované růstovým faktorem beta v netransformovaných, onkogenem transformovaných a lidských rakovinných buňkách“. Molekulární a buněčná biologie. 22 (23): 8184–98. doi:10.1128 / mcb.22.23.8184-8198.2002. PMC 134072. PMID 12417722.
- ^ Yeh CT, Lu SC, Chao CH, Chao ML (květen 2003). „Zrušení interakce mezi cyklin-dependentní kinázou 2 a Cdk-asociovanou proteinovou fosfatázou zkráceným KAP mutantem“. Sdělení o biochemickém a biofyzikálním výzkumu. 305 (2): 311–4. doi:10.1016 / s0006-291x (03) 00757-5. PMID 12745075.
- ^ Hannon GJ, Casso D, Beach D (březen 1994). „KAP: fosfatáza s dvojí specificitou, která interaguje s cyklin-dependentními kinázami“. Sborník Národní akademie věd Spojených států amerických. 91 (5): 1731–5. Bibcode:1994PNAS ... 91.1731H. doi:10.1073 / pnas.91.5.1731. PMC 43237. PMID 8127873.
- ^ A b Harper JW, Adami GR, Wei N, Keyomarsi K, Elledge SJ (listopad 1993). „Protein C21 interagující s p21 Cip1 je silným inhibitorem kináz G1 závislých na cyklinu“. Buňka. 75 (4): 805–16. doi:10.1016 / 0092-8674 (93) 90499-g. PMID 8242751.
- ^ Wang H, Iakova P, Wilde M, Welm A, Goode T, Roesler WJ, Timchenko NA (říjen 2001). „C / EBPalfa zastavuje buněčnou proliferaci přímou inhibicí Cdk2 a Cdk4“. Molekulární buňka. 8 (4): 817–28. doi:10.1016 / s1097-2765 (01) 00366-5. PMID 11684017.
- ^ Sweeney C, Murphy M, Kubelka M, Ravnik SE, Hawkins CF, Wolgemuth DJ, Carrington M (leden 1996). "Zřetelný cyklin A je exprimován v zárodečných buňkách myši". Rozvoj. 122 (1): 53–64. PMID 8565853.
- ^ Yang R, Morosetti R, Koeffler HP (březen 1997). "Charakterizace druhého lidského cyklinu A, který je vysoce exprimován ve varlatech a v několika leukemických buněčných liniích". Výzkum rakoviny. 57 (5): 913–20. PMID 9041194.
- ^ Müller-Tidow C, Wang W, Idos GE, Diederichs S, Yang R, Readhead C, Berdel WE, Serve H, Saville M, Watson R, Koeffler HP (duben 2001). „Cyklin A1 přímo interaguje s B-myb a cyklin A1 / cdk2 fosforylátem B-myb na funkčně důležitých zbytcích serinu a threoninu: tkáňově specifická regulace funkce B-myb“. Krev. 97 (7): 2091–7. doi:10.1182 / krev.v97.7.2091. PMID 11264176.
- ^ Brown NR, Noble ME, Endicott JA, Johnson LN (listopad 1999). "Strukturální základ pro specificitu substrátu a náborových peptidů pro cyklin-dependentní kinázy". Přírodní buněčná biologie. 1 (7): 438–43. doi:10.1038/15674. PMID 10559988. S2CID 17988582.
- ^ A b C Shanahan F, Seghezzi W, Parry D, Mahony D, Lees E (únor 1999). „Cyklin E se asociuje s BAF155 a BRG1, složkami savčího komplexu SWI-SNF, a mění schopnost BRG1 indukovat zastavení růstu“. Molekulární a buněčná biologie. 19 (2): 1460–9. doi:10.1128 / mcb.19.2.1460. PMC 116074. PMID 9891079.
- ^ A b McKenzie PP, Danks MK, Kriwacki RW, Harris LC (červenec 2003). „D21 dysfunkce P21Waf1 / Cip1 v neuroblastomu: nový mechanismus oslabení zástavy buněčného cyklu G0-G1“. Výzkum rakoviny. 63 (13): 3840–4. PMID 12839982.
- ^ Koff A, Giordano A, Desai D, Yamashita K, Harper JW, Elledge S, Nishimoto T, Morgan DO, Franza BR, Roberts JM (září 1992). "Tvorba a aktivace komplexu cyklin E-cdk2 během G1 fáze cyklu lidských buněk". Věda. 257 (5077): 1689–94. Bibcode:1992Sci ... 257.1689K. doi:10.1126 / science.1388288. PMID 1388288.
- ^ Mayer C, Zhao J, Yuan X, Grummt I (únor 2004). „Aktivace transkripčního faktoru TIF-IA závislá na mTOR spojuje syntézu rRNA s dostupností živin“. Geny a vývoj. 18 (4): 423–34. doi:10,1101 / gad.285504. PMC 359396. PMID 15004009.
- ^ Boudrez A, Beullens M, Groenen P, Van Eynde A, Vulsteke V, Jagiello I, Murray M, Krainer AR, Stalmans W, Bollen M (srpen 2000). „Interakce proteinové fosfatázy-1 zprostředkovaná NIPP1 s CDC5L, regulátorem sestřihu pre-mRNA a mitotického vstupu“. The Journal of Biological Chemistry. 275 (33): 25411–7. doi:10,1074 / jbc.M001676200. PMID 10827081.
- ^ Henneke G, Koundrioukoff S, Hübscher U (červenec 2003). „Fosforylace lidského Fen1 cyklin-dependentní kinázou moduluje jeho roli v regulaci replikační vidlice“. Onkogen. 22 (28): 4301–13. doi:10.1038 / sj.onc.1206606. PMID 12853968.
- ^ Méndez J, Zou-Yang XH, Kim SY, Hidaka M, Tansey WP, Stillman B (březen 2002). „Velká podjednotka pro rozpoznávání lidského původu je degradována ubikvitinem zprostředkovanou proteolýzou po zahájení replikace DNA“. Molekulární buňka. 9 (3): 481–91. doi:10.1016 / s1097-2765 (02) 00467-7. PMID 11931757.
- ^ A b Yam CH, Ng RW, Siu WY, Lau AW, Poon RY (leden 1999). "Regulace cyklinu A-Cdk2 pomocí SCF složky Skp1 a F-box proteinu Skp2". Molekulární a buněčná biologie. 19 (1): 635–45. doi:10,1128 / mcb.19.1.635. PMC 83921. PMID 9858587.
- ^ Ono T, Kitaura H, Ugai H, Murata T, Yokoyama KK, Iguchi-Ariga SM, Ariga H (říjen 2000). „TOK-1, nový protein vázající p21Cip1, který kooperativně zvyšuje inhibiční aktivitu závislou na p21 vůči CDK2 kináze“. The Journal of Biological Chemistry. 275 (40): 31145–54. doi:10,1074 / jbc.M003031200. PMID 10878006.
- ^ A b Cheng A, Kaldis P, Solomon MJ (listopad 2000). „Defosforylace lidských cyklin-dependentních kináz proteinovými fosfatázami typu 2C alfa a beta 2 izoformy“. The Journal of Biological Chemistry. 275 (44): 34744–9. doi:10,1074 / jbc.M006210200. PMID 10934208.
- ^ Leng X, Noble M, Adams PD, Qin J, Harper JW (duben 2002). "Zvrat potlačení růstu p107 přímou fosforylací cyklinem D1 / cyklin-dependentní kinázou 4". Molekulární a buněčná biologie. 22 (7): 2242–54. doi:10.1128 / mcb.22.7.2242-2254.2002. PMC 133692. PMID 11884610.
- ^ Lacy S, Whyte P (květen 1997). „Identifikace domény p130 zprostředkující interakce s komplexy cyklin A / cdk 2 a cyklin E / cdk 2“. Onkogen. 14 (20): 2395–406. doi:10.1038 / sj.onc.1201085. PMID 9188854.
- ^ Marti A, Wirbelauer C, Scheffner M, Krek W (květen 1999). „Interakce mezi ubikvitin-protein ligázou SCFSKP2 a E2F-1 je základem regulace degradace E2F-1.“ Přírodní buněčná biologie. 1 (1): 14–9. doi:10.1038/8984. PMID 10559858. S2CID 8884226.
Další čtení
- Kaldis P, Aleem E (listopad 2005). „Soupeření sourozenců buněčného cyklu: Cdc2 vs. Cdk2“. Buněčný cyklus. 4 (11): 1491–4. doi:10,4161 / cc.4.11.2124. PMID 16258277.
- Moore NL, Narayanan R, Weigel NL (únor 2007). „Cyklin dependentní kináza 2 a regulace aktivity lidského receptoru progesteronu“. Steroidy. 72 (2): 202–9. doi:10.1016 / j.steroids.2006.11.025. PMC 1950255. PMID 17207508.
externí odkazy
- Závislé na cyklinu + kináza + 2 v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- CDK2 umístění lidského genu v UCSC Genome Browser.
- CDK2 podrobnosti o lidském genu v UCSC Genome Browser.